Az ásványianyag-hiány tünetei nem mindig nyilvánvalóak: lehetnek enyhébb panaszok, mint izomgörcsök vagy fáradtság, de akár komolyabb következmények is felléphetnek, ha például a kalcium-magnézium arány vagy a nátrium-kálium egyensúly borul fel. Ezek az ásványi anyagok hiányának tünetei gyakran csak laborvizsgálattal azonosíthatók pontosan – és ez adja a személyre szabás alapját.
A cikkben megtudod, hogy mely állapotok esetén szükséges sokkal több ásványi anyagot bevinni, valamint hogyan hatnak egymásra ezek az ásványi anyagok, és mire érdemes különösen figyelni a pótlás során.
Ásványi anyagok és mentális egészség: amit már 50 éve is tudtunk
Tudtad, hogy már az 1970-es években is kutatták, milyen hatással vannak az ásványi anyagok a mentális egészségre? Carl Pfeiffer, MD, PhD, a biokémiai pszichiátria egyik úttörője 1975-ben írta meg a Mental and Elemental Nutrients című könyvét, amelyben részletesen bemutatja, hogy a mentális betegségek hátterében gyakran ásványianyag-hiány és egyensúlytalanság áll.
Pfeiffer kutatásai szerint például a cink és a réz aránya befolyásolhatja a szorongást és a depressziót, míg a magnéziumhiány növelheti a stresszre adott negatív reakciókat. Az ásványi anyagok hiányának tünetei között szerepelhet az alvászavar, ingerlékenység vagy akár koncentrációzavar is. Ezek a panaszok sok esetben felszívódási zavarral vagy nem megfelelő táplálkozással függnek össze.
Mentális betegségek és mikrotápanyagok kapcsolata
A modern kutatások is megerősítik Pfeiffer korai megfigyeléseit: a szorongás, depresszió, figyelemzavarok gyakran összefüggésbe hozhatók mikrotápanyag-hiánnyal. A króm, szelén, jód, mangán és a legismertebb ásványi anyagok, mint a magnézium, közvetlen hatással vannak az agyi folyamatokra és a hormonális működésre.
Mik azok az ásványi anyagok?
Az ásványi anyagok olyan szervetlen nyomelemek és makroelemek, melyek szervezetünk normál működéséhez nélkülözhetetlenek, és összességükben testünk 4-5%-át teszik ki.
Mik azok a makroelemek?
A makroelemekből szervezetünknek nagyobb mennyiségre van szüksége. A főbb makroelemek a következők:
- Kalcium
- Foszfor
- Kálium
- Nátrium
- Magnézium
- Klorid
- Kén
A makroelemek napi szükséglete általában 100 mg felett van, és grammos nagyságrendben is jelen lehetnek a testünkben.
Mik azok a mikroelemek, azaz nyomelemek?
A mikroelemekből (nyomelemekből) kisebb mennyiség is elegendő a szervezet számára. A főbb mikroelemek (nyomelemek) a következők:
- Vas
- Cink
- Réz
- Mangán
- Jód
- Fluor
- Szelén
- Króm
- Molibdén
A nyomelemekből napi szinten kevesebb, mint 100 mg szükséges, és a testben milligrammos vagy akár mikrogrammos mennyiségben vannak jelen.
Miért fontos az ásványi anyagok pótlása?
Az ásványi anyagok a szervezet számos élettani folyamatában részt vesznek, például:
- vérképzés
- idegrendszer és izmok működése
- sejtek közötti információátvitel
- pajzsmirigy hormontermelése
- anyagcsere-folyamatok
A táplálékból származó természetes bevitelt érdemes előnyben részesíteni, de ha ez nem elegendő, szükséges lehet ásványianyag pótlás étrend-kiegészítőkkel, mint például a szerves tri-kálium mátrix, malát és citrát formájú hasznosuló szerves magnézium.
Mikor nő meg a szervezet ásványi anyag igénye?
A legismertebb ásványi anyagok – például a kalcium, a magnézium, a kálium, a vas vagy a cink – a test normál működéséhez nélkülözhetetlenek. Ezek felszívódása azonban nem mindig optimális, egyes élethelyzetekben különösen fontos a megfelelő pótlás:
-
- intenzív fizikai aktivitás, sport esetén,
- mentális megterhelés alatt, stresszes időszakban,
- várandósság, szoptatás időszaka alatt,
- felszívódási zavarral járó állapotok során, valamint
- erős menstruáció esetén is.
A fenti esetekben táplálékból nem mindig tudjuk természetes módon, elegendő mennyiségben biztosítani szervezetünk számára az optimális mennyiséget, ezért ilyenkor elengedhetetlen a pótlásuk.
Azonban figyelni kell az ásványi anyagok felszívódására és azok szinergikus működésére is. Bizonyos elemeket, mint például a magnéziumot és kalciumot mindig megfelelő arányban kell bevinnünk.
Miért fontos az ásványi anyag egyensúly?
Az ásványi anyagok nem elszigetelten hatnak, hanem együtt lépnek működésbe, és kölcsönhatásban vannak egymással. Ezért az egészség megőrzéséhez az arányok fenntartása elengedhetetlen.
Hogyan hatnak egymásra az ásványi anyagok?
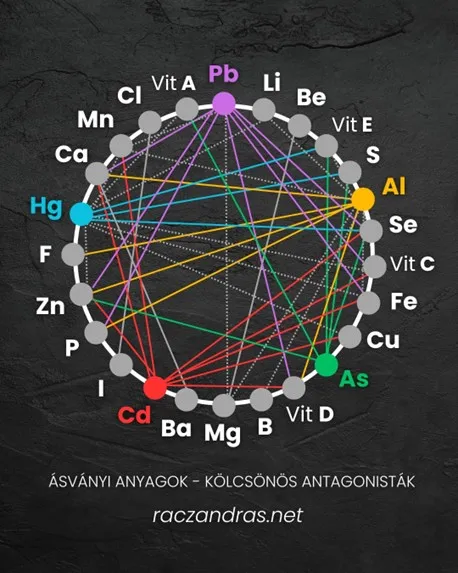
1. Antagonizmus – amikor az egyik gátolja a másikat
Bizonyos ásványi anyagok versengenek egymással a felszívódásért. Például:
- A túlzott cinkbevitel csökkentheti a réz szintjét, ami vérszegénységet és gyenge immunrendszert eredményezhet.
- A túl sok kalcium gátolhatja a magnézium hasznosulását, ami izomgörcsökhöz és fáradékonysághoz vezethet.
2. Szinergia – amikor az ásványi anyagok támogatják egymást
Bizonyos ásványok együtt erősítik egymás hatását:
- A magnézium és a kálium együtt szabályozzák az idegrendszert és az izomműködést.
- A vas és a C-vitamin segítik egymás felszívódását, ami elengedhetetlen a megfelelő oxigénellátáshoz.
3. Optimális arányok – amikor az egyensúly a kulcs
Egyes ásványok csak meghatározott arányban működnek jól együtt:
- A nátrium és a kálium egyensúlya döntő a vérnyomás és a sejtek vízháztartásának szabályozásában.
- A cink, réz és vas aránya befolyásolja az immunrendszer és a hormonrendszer működését.
Éppen ezért elengedhetetlen a laboralapú mikrotápanyag-beállítás, hogy pontosan lássuk, mely ásványi anyagokból van hiány vagy túltengés a szervezetben, és hogyan lehet azokat megfelelően korrigálni.
Milyen tüneteket okozhat az ásványi anyag hiány és egyensúlytalansága?
Ha az ásványi anyagok nem megfelelő arányban vannak jelen a szervezetben, az számos egészségügyi problémát okozhat.
Az alábbiakban felsorolok több gyakran előforduló tünetet, és az ezekre általában jellemző ásványianyag-hiányt, de ezek a tünetek általában komplex eltolódásokat jeleznek, így más felborulás is jelen lehet. Nagyon fontos, hogy ne vágj bele ásványi anyag pótlásba laborvizsgálat nélkül, és ezenfelül a labort megfelelően kell értelmezni, ebben a segítségedre tudok lenni.
- Krónikus fáradtság – lehet magnéziumhiány vagy káliumhiány jele.
- Alvászavarok, szorongás – utalhat cinkhiányra vagy túlzott rézszintre, esetleg nátriumhiányra.
- Puffadás, emésztési gondok – összefügghet nátrium- és káliumarány felborulásával.
- Izomgörcsök, szívritmuszavarok – lehet káliumhiány vagy kalcium-magnézium egyensúly problémájára.
A laborvizsgálatok segítenek pontosan meghatározni, milyen eltérések vannak a szervezetben, és ezekre személyre szabott táplálkozási és étrend-kiegészítési javaslatokat lehet adni.
Ásványi anyag pótlás folyamata: hogyan érheted el az optimális egyensúlyt?
A célzott ásványi anyag beállítás három alapvető lépésből áll:
- Laborvizsgálat elvégzése: vér- és hajelemzés alapján pontos képet kapunk a szervezet ásványianyag-szintjeiről.
- Személyre szabott étrend kialakítása: az eredmények alapján összeállított laborra szabott táplálkozás biztosítja, hogy az ásványi anyagokat optimális arányban vigyük be.
- Tudatos étrend-kiegészítés: szükség esetén kiegyensúlyozott ásványianyag-pótlás történik, nem csupán egy-egy elem izolált bevitele.
Sokan esnek abba a hibába, hogy csak egy-egy ásványt pótolnak anélkül, hogy figyelembe vennék az egész rendszer működését, pedig az egymáshoz viszonyított arányok nagyon fontosak, ellenkező esetben több kellemetlen tünet és probléma is megjelenhet, mint korábban volt. Ez könnyen elkerülhető a laborvizsgálat alapján, szakértői segítséggel beállított mikrotápanyag-bevitellel.
Az ásványi anyagok felszívódásának titkai és miért nem mindegy, hogyan pótoljuk őket?
A legtöbb ember nem a megfelelő formában pótolja az ásványi anyagait. Az ásványi anyagok felszívódása nem csupán a bevitt mennyiségtől függ, hanem attól is, hogy milyen formában kerülnek be a szervezetbe. Például a szervetlen anyagok, mint a szervetlen kalcium vagy magnézium, sok esetben nehezebben szívódnak fel a bélfalakon, és csak kis mennyiségben hasznosulnak.
Jól hasznosuló magnézium
A magnézium például, mint a magnézium-oxid, sokkal kevésbé szívódik fel. Ezzel szemben a magnézium citrát vagy biszglicinát, amely jól hasznosuló szerves magnéziumot tartalmaz, lényegesen jobban felszívódik a szervezetben. Ezért, ha nem figyelünk oda, lehet hogy sokkal kevesebb ásványi anyagot juttatunk be, mint amennyire valójában szükség van.
A kalciumot és a magnéziumot például mindig megfelelő arányban szükséges bevinnünk, hogy a testünk hatékonyan tudja őket felhasználni. A kalcium szuboptimális túladagolása például a magnézium felszívódását gátolhatja, és ez hosszú távon fáradtságot, izomgörcsöket vagy akár szívritmuszavart is okozhat.
Megfelelő kálcium források
Egy másik érdekes tényező, hogy a tejtermékek sok ember számára a fő kalciumforrást jelenthetik, ám sokan szenvednek felszívódási zavarral, ami azt jelenti, hogy a tejben található kalciumot nem tudják megfelelően hasznosítani. Éppen ezért az ásványi anyagok pótlása étrend-kiegészítőkkel egyre fontosabbá válik, különösen a szerves, jól hasznosuló formák választása.
Egy szinte elfeledett, de egyre inkább előtérbe kerülő kiegészítő a korall por, amely a kalcium mellett más ásványi anyagokat is tartalmaz, segítve a csontok és az egész test egyensúlyának fenntartását. A korall por természetes forrása a szerves kalciumnak, amely segíthet a test számára szükséges ásványi anyagok pótlásában.
Ásványianyag-pótlás személyre szabása
Az ásványi anyagok pótlásának folyamata nem csupán a mennyiségről szól. A laborvizsgálatok, melyek segítenek feltérképezni, milyen ásványi anyagok hiányoznak a szervezetből, alapvető fontosságúak a személyre szabás szempontjából. A labor mellett még a megjelenő tünetegyüttes ismerete is sokat segít az egyéni étrend és kiegészítők összeállításában.
A statisztika és a tudományos alapú mikrotápanyag-beállítások segíthetnek abban, hogy pontosan megtudd, mely ásványi anyagok vannak túlsúlyban, és hogyan korrigálhatók azok a legoptimálisabb módon.
Ásványianyag komplex készítmények, amelyek vegyesen tartalmaznak többféle mikrotápanyagokat, például a krómot, mangánt, szelént vagy a legfontosabb nyomelemeket, mint a jód, alapvetően NEM ajánlottak. Mivel minden ember egyéni, ezért mindenkinek más mennyiség szükséges az egyes elemekből, és ezek a komplex készítmények sokak számára nem megfelelő arányokban tartalmazza a szükséges ásványi anyagokat. A legjobb, ha labor alapján történik a mikrotápanyag bevitel beállítása.
Összegzés: amit érdemes megjegyezni
Az ásványi anyagok és nyomelemek nemcsak a csontok egészségére, hanem a szívritmuszavarra, izomgörcsökre és más tünetekre is hatással vannak. Az ásványi anyagok szoros kapcsolatban állnak a test működéséhez nélkülözhetetlen élettani folyamatokkal, és a megfelelő egyensúly fenntartása alapvetően befolyásolja a fizikai és mentális állapotunkat egyaránt.
- Az ásványi anyagok egyensúlya kulcs az egészség fenntartásához.
- A hiányának vagy túlzott bevitelének tünetei akár hosszú távon is károsak
- A laborra szabott táplálkozás és az egyéni állapothoz igazított ásványianyag pótlás segíthet a szélesebb körű funkcionalitáshoz.
- Válassz szerves, jól szívódó formákat, mint a malát, citrát, vagy korall por alapú kiegészítők.
Szeretnél többet tudni, vagy személyre szabott mikrotápanyag-beállítást? Írj bátran, segítek!
-
https://www.traceelements.com/EducationalResources/PublishedArticles.aspx
Ortomolekuláris orvostudományi folyóirat: Tápanyag kölcsönhatások – vitaminok és ásványi anyagok.
-
Lead
-
Calcium (Ca) and Phosphorus (P)
-
Ziegler, E. E., Edwards, B. B., Jensen, R. L., Mahaffey, K. R., and Fomon, S. J. 1978. Absorption and retention of lead by infants. Pediatr. Res. 12: 29.
-
Heard, M. J. and Chamberlain, A. C. 1982. Effect of minerals and food on uptake of lead from the gastrointestinal tract in humans. Human Toxicol 1: 411
-
Blake, K. C. H. and Mann, M. 1983. Effect of calcium and phosphorus on the gastrointestinal absorption of 203Pb in man. Environ. Res. 30: 188.
-
Heard, M. J., Chamberlain, A. C., and Sherlock, J. C. 1983. Uptake of lead by humans and effect of minerals and food. Sci. Total Environ. 30: 245.
-
Goyer RA. Nutrition and metal toxicity. Am J Clin Nutr 61(Suppl):646S-650S (1995).
-
Iron (Fe)
Yip, R., Norris, T. N., and Anderson, A. S. 1981. Iron status of children with elevated blood lead concentrations. J. Pediatr. 98: 922.
-
Mahaffey, K. R. and Annest, J. L. 1986. Association of erythrocyte protoporphyrin with blood lead level and iron status in the second National Health and Nutrition Examination Survey, 1976-1980. Environ. Res. 41: 327.
-
Watson, W. S., Hume, R., and Moore, M. R. 1980. Oral absorption of lead and iron. Lancet 2: 236.
-
Watson, W. S., Moore, M. R., and Hume, R. 1980. Oral absorption of lead and iron. Lancet 2: 699.
-
Flanagan, P. R., Chamberlain, M. J., and Valberg, L. S. 1982. The relationship between iron and lead absorption in humans. Am. J. Clin. Nutr. 36: 823.
-
Watson, W. S., Morrison, J., Bethel, M. I. F., Baldwin, N. M., Lyon, D. T. B., Dobson, H., Moore, M. R., and Hume, R. 1986. Food iron and lead ab sorption in humans. Am. J. Clin. Nutr. 44: 248.
-
Goyer RA. Nutrition and metal toxicity. Am J Clin Nutr 61(Suppl):646S-650S (1995).
-
Vitamin D
Rosen, J. F., Chesney, R. W., Hamstra, A., DeLuca, H. P., and Mahaffey, K. R. 1980. Reduction in 1,25-dihydroxyvitamin D in children with increased lead absorption. N. Engl. J. Med. 302: 1128.
-
Mahaffey, K. R., Rosen, J. P., Chesney, R. W., Peeler, J. T., Smith, C. M., and DeLuca, H. P. 1982. Association between age, blood lead concentration, and serum 1,25-dihydroxycholecalciferol levels in children. Am. J. Clin. Nutr. 35: 1327.
Zinc (Zn)
-
Lauwerys, R., Roels, H., Buchet, J. -P., Bernard, A. A„ Verhoeven, L., and Konings, J. 1983. The influence of orally-administered vitamin C or zinc on the absorption of and the biological response to lead. J. Occup. Med. 25: 668.
-
Petering HG. Some observations on the interaction of zinc, copper, and iron metabolism in lead and cadmium toxicity. Environ Health Perspect 25:141-145 (1978).
-
Goyer RA. Nutrition and metal toxicity. Am J Clin Nutr 61(Suppl):646S-650S (1995).
-
Vitamin C (Ascorbic Acid)
-
Lauwerys, R., Roels, H., Buchet, J. -P., Bernard, A. A„ Verhoeven, L., and Konings, J. 1983. The influence of orally-administered vitamin C or zinc on the absorption of and the biological response to lead. J. Occup. Med. 25: 668.
-
Mercury
Selenium (Se)
-
Goyer RA. Nutrition and metal toxicity. Am J Clin Nutr 61(Suppl):646S-650S (1995).
-
Sulphur (S)
-
Gochfeld, M., & Burger, J. (2021). Mercury interactions with selenium and sulfur and the relevance of the Se:Hg molar ratio to fish consumption advice. Environmental science and pollution research international, 28(15), 18407–18420.
-
Zalups R. K. (2000). Molecular interactions with mercury in the kidney. Pharmacological reviews, 52(1), 113–143.
-
Copper (Cu)
-
Funk AE, Day FA, Brady FO. Displacement of zinc and copper-induced metallothionein by cadmium and by mercury: in vivo and ex vivo studies. Comp Biochem Physiol C Pharmacol Toxicol 86:1-6 (1987).
-
Cadmium-Nutrient interactions in Animals
-
Zinc (Zn)
-
Fox, M. R. S., Tao, S. -H., Stone, C. L., and Fry, B. E., Jr. 1984. Effects of zinc, iron and copper deficiencies on cadmium in tissues of Japanese quail. Environ. Health Perspect. 54: 57.
-
Waalkes, M. P. 1986. Effect of dietary zinc deficiency on the accumulation of cadmium and metallothionein in selected tissues of the rat. J. Toxicol Environ. Health 18: 301.
-
Hoadley, J. E. and Cousins, R. J. 1985. Effects of dietary zinc depletion and food restriction on intestinal transport of cadmium in the rat. Proc. Soc. Exp. Biol Med. 180; 296.
-
Andersen 0, Nielsen JB, Sorensen JA, Scherrebeck L. Experimental localization of intestinal uptake sites for metals (Cd, Hg, Zn, Se) in vivo in mice. Environ Health Perspect 102(Suppl 3):199-206 (1994).
-
Snaith SM, Levvy GA. Purification and properties of a-D-mannosidase from rat epididymis. Biochem J 114:25-33 (1969).
-
Lai JB. The Effects of Low and High Levels of Dietary Zinc on Pathology in Rats Exposed to Cadmium. Ph.D. Thesis. University of Cincinnati, Cincinnati, Ohio, 1976.
-
Tanaka M, Yanagi M, Shirota K, Une Y, Nomura Y, Masaoka T, Akahori F. Effect of cadmium in the zinc deficient rat. Vet Hum Toxicol 37:203-208 (1995).
-
Supplee WC. Production of zinc deficiency in turkey poults by dietary cadmium. Poult Sci 40:827 (1961).
-
Iron (Fe)
-
Fox, M. R. S., Tao, S. -H., Stone, C. L., and Fry, B. E., Jr. 1984. Effects of zinc, iron and copper deficiencies on cadmium in tissues of Japanese quail. Environ. Health Perspect. 54: 57.
-
Fox, M. R. S., Jacobs, R. M., Jones, A. O. L., Fry, B. E. Jr., and Stone, C. L. 1980. Effects of vitamin C and iron on cadmium metabolism. N. Y. Acad. Sci 355: 249.
-
Leon, L. and Johnson, D. R. 1985. Role of iron in jejunal uptake of cadmium in the newborn rat. J. Toxicol. Environ. Health, 15: 687.
-
Kostial, K., Rabar, I., Blanusa, M., and Simonovic, I. 1980. The effect of iron additive to milk on cadmium, mercury and manganese absorption in rats. Environ. Res. 22: 40.
-
Johnson, D. R., Foulkes, E. C., and Leon, L. 1981. Intestinal transport of cadmium in newborn rats. Fed. Proc. 40: 1073.
-
Huebers, H. A., Huebers, E., Csiba, E., Rummel, W., and Finch, C. A. 1987. The cadmium effect on iron absorption. Am. J. Clin. Nutr. 45: 1007.
-
Webster, W. S. 1979. Iron deficiency and its role in cadmium-induced fetal growth retardation. J. Nutr. 109: 1640.
-
Siewicki, T. C., Sydlowski, J. S., Van Dolah, F. M., and Balthrop, J. E., Jr. 1986. Influence of dietary zinc and cadmium on iron bioavailability in mice and rats: Oyster versus salt sources. J. Nutr. 116: 281.
-
Stonard MD, Webb M. Influence of dietary cadmium on the distribution of the essential metals copper, zinc and iron in tissues of the rat. Chem Biol Interact 15:349-363 (1976).
-
Fox MRS, Fry BE Jr. Cadmium toxicity decreased by dietary ascorbic acid supplements. Science 169:989 (1970).
-
Copper (Cu)
-
Fox, M. R. S., Tao, S. -H., Stone, C. L., and Fry, B. E., Jr. 1984. Effects of zinc, iron and copper deficiencies on cadmium in tissues of Japanese quail. Environ. Health Perspect. 54: 57.
-
Mills CF, Dalgarno AC. Copper and zinc status of ewes and lambs receiving increased dietary concentrations of cadmium. Nature 239:171-173 (1972).
-
Evans GW, Majors PF, Cornatzer WE. Mechanism for cadmium and zinc antagonism of copper metabolism. Biochem Biophys Res Commun 40:1142 (1970).
-
Rothe S, Gropp J, Weiser H, Rambeck WA. The effect of vitamin C and zinc on the copper-induced increase of cadmium residues in swine [in German]. Z Ernahrungswiss 33:61-67 (1994).
-
Calcium (Ca)
-
Van Barneveld, A. A. and Van den Hamer, J. A. 1985. Influence of Ca and Mg on the uptake and deposition of Pb and Cd in mice. Toxicol Appl Pharmacol 79: 1.
-
Revis, N. W., Major, T. C., and Horton, C. Y. 1980. The effects of calcium, magnesium, lead or cadmium on lipoprotein metabolism and atherosclerosis in the pigeon. J. Environ. Pathol. Toxicol. 4-2, 3: 293.
-
Chertok, R. J., Sasser, L. B., Callahan, M. F., and Jarboe, G. E. 1981. Influence of cadmium on the intestinal uptake and absorption of calcium in the rat. J. Nutr. Ill: 631.
-
Hoadley, J. E. and Johnson, D. R. 1987. Effects of calcium on cadmium uptake and binding in the rat intestine. Fundam. Appl. Toxicol 9: 1.
-
Ando M, Shimizu M, Sayato Y, Tanimura A, Tobe M. The inhibition of vitamin D-stimulated intestinal calcium transport in rats after continuous oral administration of cadmium. Toxicol Appl Pharmacol 61:297-301 (1981).
-
Wang C, Bhattacharyya MH. Effect of cadmium on bone calcium and 45Ca in nonpregnant mice on a calcium-deficient diet: evidence of direct effect of cadmium on bone. Toxicol Appl Pharmacol 120:228-239 (1993).
-
Rimbach G, Pallauf J, Brandt K, Most E. Effect of phytic acid and microbial phytase on Cd accumulation, Zn status, and apparent absorption of Ca, P, Mg, Fe, Zn, Cu, and Mn in growing rats. Ann Nutr Metabolism 39:361-370 (1995).
-
Selenium (Se)
-
Olsson, U. 1985. Selenium deficiency and detoxication functions in the rat: Effect of chronic dietary cadmium. Drug Nutr. Interact. 3: 129.
-
Rahim, A. G. A, Arthur, J. R., and Mills, C. F. 1986. Effects of dietary cop per, cadmium, iron, molybdenum and manganese on selenium utilization by the rat. J. Nutr. 116: 403.
-
Flegal, K. M., Cary, E. E., Pond, W. G., and Krook, L. P. 1980. Dietary selenium and cadmium interrelationships in growing swine. J. Nutr. 110: 1255.
-
Perry, H. M., Erlanger, M. W., and Perry, E. F. 1983. Effect of a second metal on cadmium-induced hypertension. Arch. Environ. Health 38: 80.
-
Manganese (Mn)
-
Jacobs, R. M., Lee. A. O. L., Fox, M. R, S., and Lener, J. 1983. Effects of dietary zinc, manganese, and copper on tissue accumulation of cadmium by Japanese quail. Proc. Sac. Exp. Biol. Med. 172: 34.
-
Sarhan, M. J., Roels, H., Lauwerys, R., Reyners, H., and Gianfelici de Reyners, E. 1986. Influence of manganese on the gastrointestinal ab sorption of cadmium in rats. J. Appl. Toxicol. 6: 313.
-
Vitamin C (Ascorbic Acid)
-
Fox, M. R. S., Jacobs, R. M., Jones, A. O. L., Fry, B. E. Jr., and Stone, C. L. 1980. Effects of vitamin C and iron on cadmium metabolism. N. Y. Acad. Sci 355: 249.
-
Cadmium-Nutrient Interactions in Humans
-
Calcium (Ca)
-
Fox MRS. Nutritional influences on metal toxicity: cadmium as a model toxic element. Environ Health Perspect 29:95-104 (1979).
-
Friberg L, Piscator M, Nordberg GF, Kjellstrom T. Cadmium in the environment. 2nd ed. Cleveland, OH:CRC Press, 1974.
-
Zinc (Zn)
-
Petering HG. Some observations on the interaction of zinc, copper, and iron metabolism in lead and cadmium toxicity. Environ Health Perspect 25:141-145 (1978).
-
Bremner I. Cadmium toxicity: nutritional influences and the role of metallothionein. World Rev Nutr Diet 32:165-197 (1978).
-
Fox MRS. Nutritional influences on metal toxicity: cadmium as a model toxic element. Environ Health Perspect 29:95-104 (1979).
-
Coleman JE, Vallee BL. Metallocarboxypeptidases: stability constants and enzymatic characteristics. J Biol Chem 236:2244-2249 (1961).
-
Cotzias GC, Papavasiliou PS. Specificity of zinc pathway through the body: homeostatic considerations. Am J Physiol 206:787-792 (1964).
-
Underwood EJ. Trace Elements in Human and Animal Nutrition. 4th ed. New York:Academic Press, 1977.
-
Parizek J. The destructive effect of cadmium ion on testicular tissue and its prevention by zinc. J Endocrinol 15:56-63 (1957).
-
Sandstead HH. Effects and dose-response relationships of toxic metals (Nordberg GF, ed). New York:Elsevier, 1976.
-
Stonard MD, Webb M. Influence of dietary cadmium on the distribution of the essential metals copper, zinc and iron in tissues of the rat. Chem Biol Interact 15:349-363 (1976).
-
Iron (Fe)
-
Flanagan, P. R., McLellan, J. S., Haist, J., Cherian, G., Chamberlain, M. J., and Valberg, L. S. 1978. Increased dietary cadmium absorption in mice and human subjects with iron deficiency. Gastroenterology 74: 841.
-
Shaikh, Z. A. and Smith, J. C. 1980. Metabolism of orally ingested cadmium in humans. In Mechanisms of Toxicity and Hazard Evaluation, Holmstedt, B., Lauwerys, R., Mercier, M., and Roberfroid, M. (Ed.), p. 569. Elsevier/North-Holland Biomedical Press, Amsterdam, The Netherlands
-
Bunker, V. W., Lawson, M. S., Delves, H. T., and Clayton, B. W. 1984. The intake and excretion of lead and cadmium by the elderly. Am. J. Clin. Nutr. 39: 803.
-
Fox MRS. Nutritional influences on metal toxicity: cadmium as a model toxic element. Environ Health Perspect 29:95-104 (1979).
-
Vahter M, Berglund M, Nermell B, Akesson A. Bioavailability of cadmium from shellfish and mixed diet in women. Toxicol Appl Pharmacol 136:332-341 (1996).
-
Petering HG, Murthy L, Cerklewski FL. Role of nutrition in heavy metal toxicity. In: Biochemical Effects on Environmental Pollutants (Lee SD, ed). Ann Arbor, MI:Science Publishers, 1977.
-
Copper (Cu)
-
Nogawa, K., Yamada, Y., Honda, R., Tsuritani, L, Kobayashi, E., and Ishizaki, M. 1984. Copper and zinc levels in serum and urine of cadmium-exposed people with special reference to renal tubular dam age. Environ. Res. 33: 29.
-
Fox MRS. Nutritional influences on metal toxicity: cadmium as a model toxic element. Environ Health Perspect 29:95-104 (1979).
-
Funk AE, Day FA, Brady FO. Displacement of zinc and copper-induced metallothionein by cadmium and by mercury: in vivo and ex vivo studies. Comp Biochem Physiol C Pharmacol Toxicol 86:1-6 (1987).
-
Vitamin D
-
Nogawa, K., Tsuritani, 1., Kido, T., Honda, R., Yamada, Y., and Ishizaki, M. 1987. Mechanism for bone disease found in inhabitants environ mentally exposed to cadmium: Decreased serum la-25-dihydroxyvitamin D \eve\.Arch. Environ. Occup. Health 59: 21.
-
Aluminium-Nutrient Interactions in Humans
-
Calcium (Ca) and Phosphorus (P)
-
Spencer, H., Kramer, L., Norris, C., and Osis, D. 1982. Effect of small doses of aluminum-containing antacids on calcium and phosphorus metabolism. Am. J. Clin. Nutr. 36: 32.
-
Insogna, K. L., Bordley, D. R., Caro. J. F.. and Lockwood, D. H. 1980. Osteomalacia and weakness from excessive antacid ingestion. J. Am. Med. Assoc. 244: 2544.
-
Vitamin D
-
Klein, 0. L., Horst, R. L., Norman, A. W., Ament, M. E., Slatopolsky, E., and Coburn, J. W, 1981. Reduced serum levels of l-alpha,25-dihydroxyvitamin D during long-term total parenteral nutrition. Ann. Int. Med. 94: 638.
-
Shike, M., Sturtridge, W. C., Tam, C. S., Elarrison, J. E., Jones, G., Murray, T. M., Husdan, H., Whitwell, J., Wilson, D. R., and Jeejeebhoy, K. N. 1981. A possible role of vitamin D in the genesis of parenteral nutrition-induced metabolic bone disease. Ann. Int. Med. 95: 560.
-
Klein, G. L„ Horst, R, L., Alfrey, A. C., and Slatopolsky, E, 1985. Serum levels of 1,25-dihydroxyvitamin D in children receiving parenteral nutrition with reduced aluminum content. J. Pediatr. Gastroenterol. Nutr. 4: 93.
-
Fluoride (F)
-
Spencer, H., Kramer, L., Osis, D., and Wiatrowski, E. 1985. Effects of aluminum hydroxide on fluoride and calcium metabolism. J. Environ. Pathol. Toxicol. Oncol. 6: 33
-
Zinc (Zn)
-
Abu-Hamdan, D. K., Mahajam, S. K., Migdal, S. D., Prasad, A. S., and McDonald, F. D. 1986. Zinc tolerance tests in uremia. Effect of ferrous sulfate and aluminum hydroxide. Int. Med. 104: 50.